열역학 용어와 순수물질의 성질
열역학 용어와 순수물질의 성질
1. 열역학의 개요와 기본 용어
열역학은 열과 에너지가 물질이나 환경과 어떻게 상호작용하며 변환되는지 연구하는 학문입니다. 기계공학, 화학공학, 에너지 시스템 등 여러 공학 분야에서 필수적인 역할을 합니다. 열역학을 효과적으로 공부하기 위해서는 기본적인 용어와 개념부터 이해하는 것이 중요합니다.
- 상태함수(State function): 시스템의 특정 상태를 나타내는 물리적 특성으로, 상태의 변화량은 출발점과 도착점의 값에만 영향을 받습니다. 압력, 부피, 온도, 내부에너지, 엔탈피, 엔트로피 등이 대표적입니다.
- 경로함수(Path Function): 상태가 변화하는 과정에 따라 달라지는 특성으로, 열(Heat)과 일(Work)이 대표적입니다. 같은 상태 변화를 겪더라도 경로에 따라 값이 달라집니다.
2. 열역학에서 사용하는 단위와 차원
열역학에서의 계산과 분석은 일반적으로 국제 단위계(SI 단위)를 사용합니다.
- 기본 단위: 질량(kg), 길이(m), 시간(s), 전류(A), 온도(K), 물질량(mol), 광도(cd)
- 자주 사용하는 압력 단위
- 1 atm = 101.325 kPa
- 1 bar = 100 kPa
- 1 MPa = 1000 kPa
- 부피 단위 환산
- 1 L = 1×10⁻³ m³
- 1 cm³ = 1×10⁻⁶ m³
이러한 단위 환산은 열역학 문제를 해결할 때 매우 중요합니다.
3. 순수물질과 상태변화
3.1 순수물질의 정의와 중요성
순수물질은 균일한 성분을 가지며 화학적으로 변화하지 않고 상태만 변하는 물질입니다. 대표적으로 물(H₂O), 습증기, 공기 등이 있으며, 이를 통해 상태 변화와 열 전달 과정을 예측하고 분석할 수 있습니다.
3.2 물의 주요 상태
물은 열역학에서 가장 많이 다루는 물질 중 하나이며, 다양한 상태로 존재합니다. 압력과 온도 조건에 따라 다음과 같은 상태로 구분됩니다.
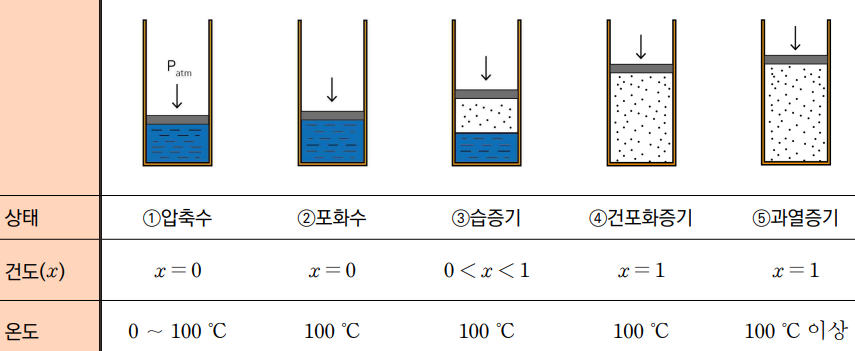
- 압축수: 포화온도 이하의 액체로 증발이 거의 일어나지 않는 상태입니다.
- 포화수: 특정 압력에서 증발이 시작되는 상태로, 대기압에서는 100℃입니다.
- 습증기: 액체와 증기가 혼합된 상태입니다.
- 건포화증기: 특정 압력에서 액체가 완전히 증발한 상태입니다.
- 과열증기: 포화증기 이상의 온도로 가열되어 응축되지 않는 상태입니다.
3.3 물의 상변화 과정
물의 상변화는 상태 간 변화가 이루어질 때 발생하며, 크게 다음 네 가지 과정으로 나뉩니다.
- 고체(얼음) → 액체(물): 융해
- 액체(물) → 기체(증기): 증발
- 기체(증기) → 액체(물): 응축
- 액체(물) → 고체(얼음): 응고
이러한 상태변화는 온도와 압력 조건에 따라 달라지며, 이를 도식화한 상태변화 그림을 통해 쉽게 이해할 수 있습니다.
3.4 순수물질의 가열곡선
가열곡선은 순수물질이 일정한 압력에서 온도 변화에 따라 상태가 어떻게 변하는지를 나타낸 그래프입니다. 가열 과정에서 상태가 바뀌는 구간은 온도가 일정하게 유지되고, 상태가 변하지 않는 구간에서는 온도가 계속 상승합니다.
- 현열(Sensible Heat): 상태 변화 없이 온도만 변화시키는 데 필요한 열량

- 잠열(Latent Heat): 상태 변화가 일어날 때 필요한 열량이며, 융해열, 증발열 등이 있습니다.
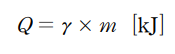
가열곡선은 열역학 개념을 시각적으로 명확히 이해하는 데 도움을 줍니다.
4. 습증기와 건도
습증기는 액체 상태와 증기 상태가 혼합된 형태입니다. 이 혼합물에서 전체 질량 중 증기가 차지하는 비율을 **건도(quality, x)**라 하며, 아래와 같이 정의됩니다.

건도(x)는 항상 0과 1 사이의 값을 가지며, 습증기의 상태량을 계산할 때 중요한 역할을 합니다.
습증기 상태량의 계산 공식
습증기의 상태량은 건도를 사용하여 간편하게 계산할 수 있습니다.
- 비체적(v): v_x = v_f + x(v_g - v_f)
- 내부에너지(u): u_x = u_f + x(u_g - u_f)
- 엔탈피(h): h_x = h_f + x(h_g - h_f)
- 엔트로피(s): s_x = s_f + x(s_g - s_f)
여기서 첨자 f는 액체 상태(포화수), g는 증기 상태(건포화증기)를 나타냅니다.
5. 열역학적 상태량: 비열과 위상변이 잠열
- 비열(Specific Heat): 단위 질량의 물질 온도를 1℃ 높이는 데 필요한 열량을 나타내며, 물질의 상태(고체, 액체, 기체)에 따라 값이 다릅니다.
- 물의 비열: C_water = 4.2 kJ/kg·K
- 얼음의 비열: C_ice = 2.1 kJ/kg·K
- 수증기의 비열: C_vapor = 1.0 kJ/kg·K
- 위상변이 잠열(Latent Heat of Phase Change): 단위 질량의 물질이 상태를 바꾸는 데 필요한 열량을 의미하며, 상변화에 따라 다릅니다.
- 얼음 → 물(융해열): λ_fusion = 332 kJ/kg
- 물 → 수증기(증발열): λ_vaporization = 2257 kJ/kg
6. 상태량의 종류와 의미
상태량은 크게 다음과 같이 분류됩니다.
· 강도성 상태량(Intensive Properties): 질량에 무관하게 일정한 값으로 나타나는 상태량으로, 압력, 온도 등이 있습니다.
· 종량적 상태량(Extensive Properties): 질량에 따라 달라지는 상태량으로, 부피와 내부에너지가 대표적입니다.
· 비상태량(Specific Properties): 종량적 상태량을 단위 질량으로 나눈 값으로, 비체적과 비엔탈피 등이 있습니다.
7. 압력과 부피의 이해
· 압력(Pressure): 면적당 작용하는 힘을 의미하며, 절대압력과 계기압으로 나누어집니다.
· 부피(Volume): 물질이 차지하는 공간을 나타내며, 시스템의 특성에 따라 다르게 고려됩니다.
8. 결론
이번 챕터에서는 열역학에서 사용하는 기본적인 용어와 순수물질의 상태 변화 및 특성을 다뤘습니다. 특히 물과 습증기의 특성과 건도 개념, 비열과 위상변이 잠열의 중요성을 이해하는 것은 이후의 열역학적 분석과 실무적 응용에 필수적입니다. 다음 챕터에서는 열역학 법칙과 실질적인 적용 사례를 더욱 깊이 알아보겠습니다.