이상기체의 개념과 상태변화
이상기체의 개념과 상태변화
1. 이상기체란?
이상기체(Ideal Gas)는 분자 간 상호작용과 분자의 부피를 무시하여 가정한 이론적 기체입니다. 실제 기체와의 차이가 있지만, 공학적 문제 해결에 이상기체 가정은 유용한 근사입니다.
2. 이상기체와 실제기체의 차이점
- 이상기체: 분자의 크기와 상호작용 무시, 비가역성 없음, 이상기체 상태 방정식을 완벽히 따름.
- 실제기체: 분자의 크기와 상호작용 존재, 비가역성 존재, 고압 및 저온 조건에서는 이상기체 방정식과 차이가 커짐.
3. 보일의 법칙과 샤를의 법칙
- 보일의 법칙(Boyle's Law): 일정한 온도에서 압력과 부피는 반비례합니다.(등온법칙)
- 샤를의 법칙(Charles's Law): 일정한 압력에서 부피는 절대온도에 비례합니다.(정적, 정압법칙)
4. 기체상수의 개념과 관계식
기체상수는 다음과 같이 두 가지로 나뉩니다.
- 일반 기체상수: 모든 기체에 공통적으로 적용되는 상수로 값은 8.314 J/mol·K입니다.
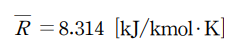
- 특정 기체상수: 특정 기체마다 고유한 값으로, 일반 기체상수를 몰질량(M)으로 나누어구합니다.

- 기체상수의 관계식: 분자량 M을 이용해 특정기체상수를 계산할 수 있습니다.
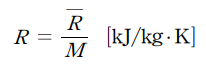
5. 이상기체 상태방정식의 표현
이상기체 상태방정식은 보일과 샤를의 법칙을 하나의 공식으로 합친 것으로 아래와 같이 다양한 형태로 표현됩니다.
- 기본형

- 밀도식
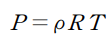
- 질량식

- 일반식

- 몰 공식(이건 잘 안씀)

여기서,
- P : 압력(Pa)
- V : 부피(m³)
- T : 절대온도(K)
- m : 질량(kg)
- M : 기체의 분자량
- ρ : 밀도
6. 기체의 비열과 그 관계식
- 정적비열: 정적과정에서의 비열 C_v
- 정압비열: 정압과정에서의 비열 C_p
- 비열비: 정적비열에 대한 정압비열의 비 [k] = C_p/C_v
- 비열 관계식:

7. 기체의 혼합
- 돌턴의 분압 법칙: 혼합된 기체의 전체 압력은 각 기체 압력의 합과 같다.

- 혼합기체의 기체상수: 돌턴의 분압 법칙에 의해 혼합기체의 기체상수는 아래와 같다.

- 혼합기체의 상대방정식: 이상기체 상태방정식에 혼합기체의 기체상수를 대입한다.

8. 줄의 법칙
내부에너지: 시스템의 잠재적 에너지의 총합

엔탈피: 내부에너지와 유동에너지의 합(H= U+PV)

9. 이상기체의 상태 변화 과정과 예시
9.1 등온 과정(Isothermal)
온도가 일정한 상태 변화이며, 보일의 법칙을 따릅니다.
- 예: 일정 온도에서 실린더 내 기체의 압축 및 팽창
9.2 정압 과정(Isobaric)
압력이 일정한 상태 변화로 샤를의 법칙이 적용됩니다.
- 예: 개방된 용기에서 기체 가열로 인한 팽창
9.3 정적 과정(Isochoric)
부피가 일정한 상태 변화입니다.
- 예: 밀폐 용기 내 가열된 기체의 압력 상승
9.4 단열 과정(Adiabatic)
외부와 열 교환 없이 일어나는 상태 변화로 관계를 따릅니다.
- 예: 엔진 실린더 내부에서 빠르게 이루어지는 압축 및 팽창
9.5 폴리트로픽 과정(Polytropic)
압력과 부피의 관계가 PV^n을 만족하는 일반적인 상태 변화입니다.
n은 폴리트로픽 지수로 0, 1, k, ∞ 의 값이 될 수 있고 각 값에 따라 정압, 등온, 단열, 정적 과정이 될 수 있다.
- 예: 실제 압축기나 팽창기에서 발생하는 상태 변화
10. 내부에너지와 엔탈피, 비열비
- 정적비열(C_v): 일정 부피 조건에서 단위 질량당 온도를 1K 올리는 데 필요한 열량입니다.
- 정압비열(C_p): 일정 압력 조건에서 단위 질량당 온도를 1K 올리는 데 필요한 열량입니다.
- 비열비(****************************************************************): 정압비열과 정적비열의 비율입니다.
이상기체에서는 내부에너지와 엔탈피가 오직 온도의 변화에만 영향을 받습니다.
- 내부에너지 변화:
- 엔탈피 변화:
11. 비열과 잠열
- 비열(Specific Heat): 단위 질량의 온도를 1℃ 상승시키는 데 필요한 열량이며, 정적 및 정압비열로 구분됩니다.
- 잠열(Latent Heat): 상변화 시 필요한 열량입니다.
- 융해열: 332 kJ/kg (얼음 → 물)
- 증발열: 2257 kJ/kg (물 → 증기)
12. 이상기체의 응용
이상기체 이론은 엔진, 터빈, 압축기 등 실제 공학 장치 설계와 성능 분석에서 널리 활용됩니다. 이상기체 방정식을 이용하면 복잡한 현실 상황을 간소화하여 효율적인 분석이 가능합니다.
13. 결론
이번 챕터에서는 이상기체의 개념과 실제기체와의 차이점, 보일과 샤를의 법칙, 기체상수의 개념과 이상기체 상태방정식의 다양한 표현을 알아보았습니다. 또한 이상기체에서 발생하는 다섯 가지 대표적인 상태 변화 과정(등온, 정압, 정적, 단열, 폴리트로픽)의 특성과 예시를 통해 상태 방정식의 실질적인 활용 방법을 살펴보았습니다. 더불어 정압비열, 정적비열, 비열비와 같은 열역학적 상태량의 개념과 내부에너지 및 엔탈피 변화에 대해서도 정리하였습니다. 이처럼 이상기체의 기본 개념과 상태 변화를 명확히 이해하는 것은 열역학적 문제를 해결하고 실제 공학 현장에서 기체의 거동을 예측하는 데 큰 도움이 됩니다. 앞으로 이어질 챕터에서는 이 개념들을 바탕으로 열역학 사이클과 엔진, 터빈, 압축기 등의 공학적 응용 사례를 더욱 깊이 있게 다루겠습니다.