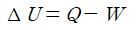열역학 제1법칙은 에너지 보존 법칙을 열역학적으로 표현한 것으로, 시스템이 겪는 모든 과정에서 "에너지는 생성되거나 소멸되지 않고 형태만 바뀐다"는 원리를 다룹니다. 본 장에서는 열역학 제1법칙의 정식 표현부터 폐쇄계(밀폐계)와 개방계에 대한 적용, 그리고 실제 공학적 해석에 필요한 주요 공식들을 폭넓게 살펴보겠습니다.1. 열역학 제1법칙의 기본 개념1.1 에너지 보존의 관점 열역학 제1법칙은 물리학에서의 에너지 보존 법칙과 동일한 의미를 갖습니다. 시스템 내부에너지의 변화(ΔU)는 시스템이 흡수한 열(Q)과 시스템이 외부에 한 일(W)의 상호작용으로 결정됩니다. 이를 식으로 표현하면 다음과 같습니다. 여기서 부호는 통상적으로 다음과 같이 설정합니다.Q > 0: 시스템으로 열이 유입(흡수)Q W > 0:..